2020/06/15
カイオムニュースレター(Vol.3)
CBA-1205初回治験計画届を提出しました
当社が開発したファースト・イン・クラスのがん治療用抗体CBA-1205の治験計画届を、2020年3月24日付で医薬品医療機器総合機構(PMDA)に提出しました。
CBA-1205は肝臓がん、肺がんなどの固形がんの細胞表面に特徴的に発現するタンパク質であるDLK-1を標的とした自社開発のヒト化抗体で、当社にとって初の臨床開発プログラムです。
現時点ではDLK-1を標的とする治療薬や開発中の治療薬候補は知られておらず、当社がこれから日本で行う治験は、DLK-1を標的とした世界で初めての臨床試験となります。
医薬開発は、新薬候補を見つけ出したとしても、治験を実施するまでには乗り越えるべきハードルがいくつもあります。
動物を用いた薬効薬理試験において強い効果を示しても、ヒトに投与するにあたり強い毒性があってはなりません。
また、ヒトに投与するための基準や品質を満たした治験薬の製造も大きな課題の一つとなります。
さらに、治験を実施する医療の現場での使いやすさも重要です。
CBA-1205はこのすべての課題をクリアして、治験計画届の提出に至ったものです。
治験の実施は、創薬ベンチャーである当社の事業活動においては大きな進展であり、この治験を確実にかつ迅速に推進することは、新たな治療法の選択肢を待つ患者さんや医療社会に対する貢献に繋がります。
ここでは治験計画届提出までの道のりを振り返ります。
治験を実施することは家の建築に似ていて、家の設計図と同じように、治験にも設計図(プロトコル)が必要です。
そして、家の建築計画が建築基準法等各種法令に適合しているか行政確認を受けるのと同様に、治験実施計画は医薬品医療機器等法に基づく安全性確保がされているかPMDAの審査を受けます。
そして、家が建築家だけでなく基礎工事、配管工事、内装などの専門の職人によって作り上げられていくように、治験の準備と実施にも経験豊富な専門家が必要です。
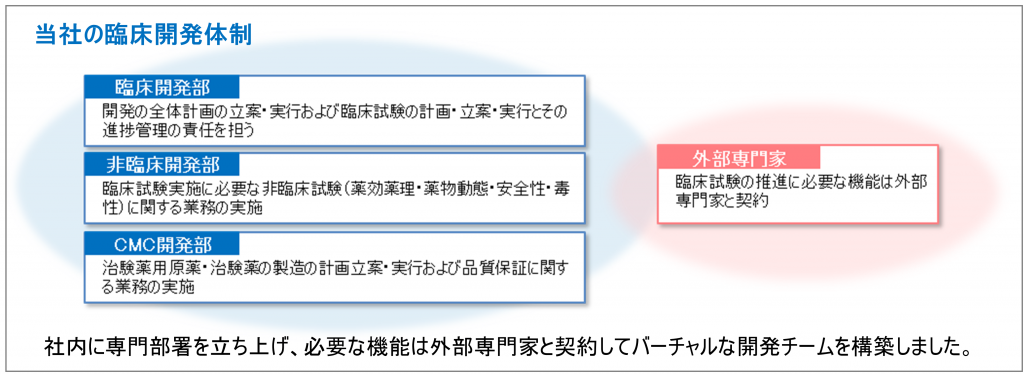
当社では、昨年、開発本部を立ち上げました。
①ヒトに投与するために必要な動物データを取得する非臨床開発部、②ヒトに投与するための治験薬を製造するCMC開発部、③治験を実施する責任部署である臨床開発部の3つの部門で構成されます。
各部門の責任者には製薬企業で抗体開発の経験がある専門性の高い人材を登用し、さらに必要な機能は外部の専門家と契約してバーチャルな開発チームを作り上げました。
これにより、自社で計画立案から治験の実施までを戦略的にかつ関連法規を遵守して推進することが可能となったのです。
前述のとおり、CBA-1205はDLK-1という新規な標的をターゲットとした世界で初めての治験です。
そのため、当社が提出するCBA-1205の治験計画届に対して、通常よりも慎重なPMDAの審査が想定されました。
PMDAの審査では、対象とする疾患において新たにCBA-1205を治療薬として開発することの意義、試験の目的に照らして試験の種類や評価項目が妥当か、治験を実施する医療機関が適切か、使用する治験薬はヒトへの投与の基準・品質を厳格に満たして生産されているか、最初にヒトに投与する薬の量や最高用量、投与間隔の設定が妥当か、そして治験に参加する患者さんの安全が確保できるか、などが確認されます。
それら一つ一つに対して当社の開発チームは、綿密な検討を重ねて治験計画届を作成し、非臨床の毒性試験や安全性薬理試験のデータなどの添付資料と合わせて3月24日にPMDAに提出しました。
治験計画届の受理から30日間の枠で行われるPMDAの審査と質疑、回答のやり取りはスムーズに進み、当社が開発したCBA-1205の治療薬候補としての可能性とその治験計画が確かなものであることの証となりました。
そして、現在当社では、年内のヒトへの投与を目指して治験施設との準備を進めています。
当社は引き続きCBA-1205の治験の成功に向けて鋭意取り組んでまいります。
