2022/06/09
カイオムニュースレター(Vol.6)
がん治療用抗体CBA-1535、Tribody抗体として世界初の臨床試験始動
~2022年5月16日CBA-1535の治験開始に向けてキックオフミーティングを実施しました~
CBA-1535の臨床試験は、今般の新型コロナウイルス感染症の収束が見通せない状況のなかで、当初計画の英国での治験ではなく、相対的に開発への影響が少ない日本国内で実施することとし、2022年2月16日付で医薬品医療機器総合機構(PMDA)への治験計画届の提出を完了いたしました。
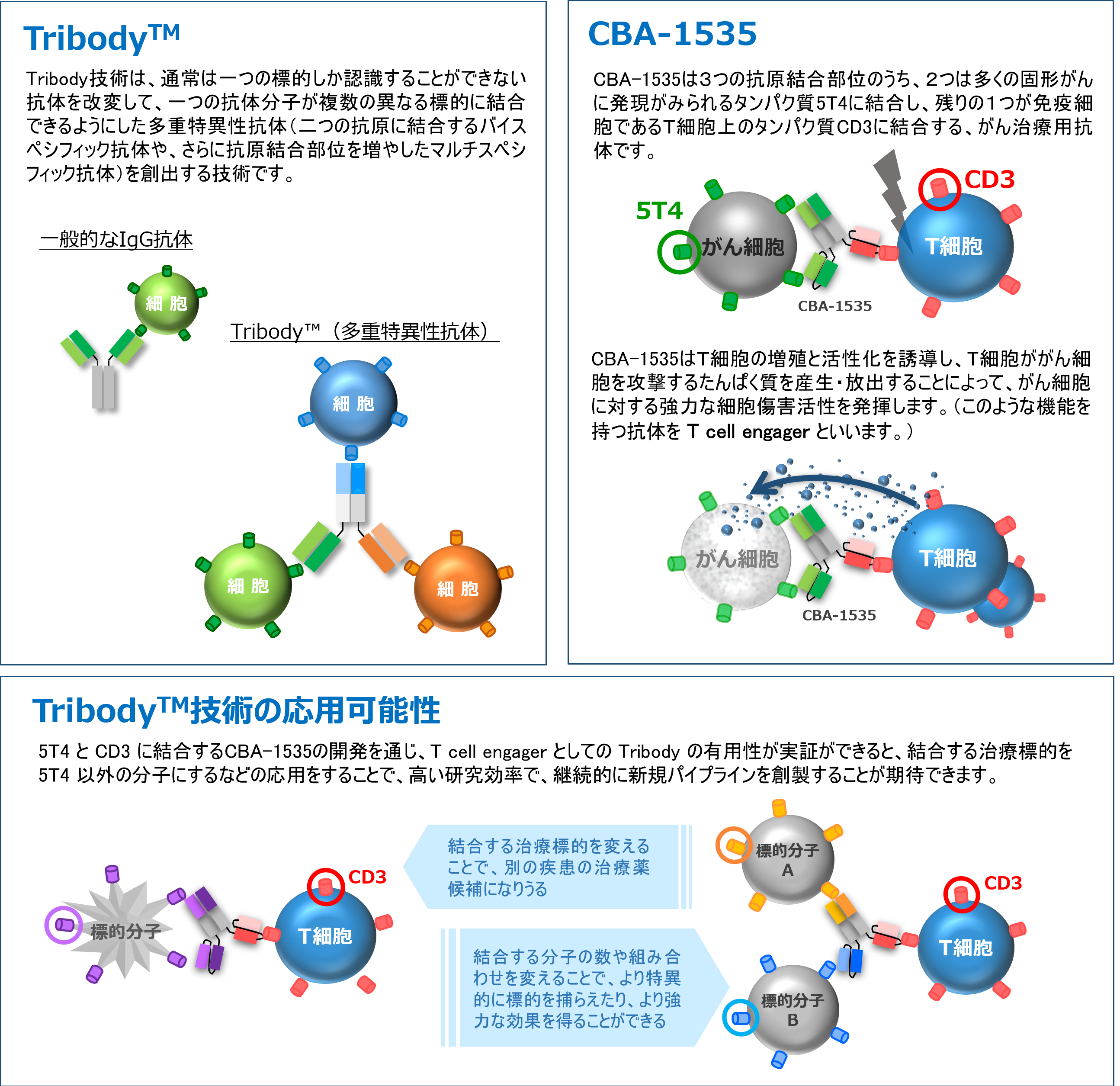
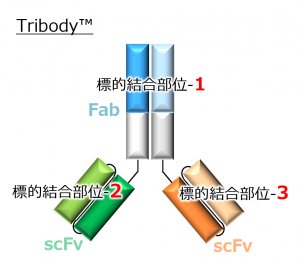
CBA-1535は当社が保有する多重特異性抗体作製技術TribodyTMを用いて創製されたがん治療用抗体であり、Tribodyとしては世界で初めての臨床試験となります。
この試験において、がん細胞と免疫細胞(T細胞)の双方に結合し、T細胞を活性化してがんを叩くというTribodyのコンセプト(T cell engager)が確認されれば、他の多くのがん抗原に対するTribodyの適用の可能性が広がることになります。
臨床第1相試験の後半パートでは、現在、世界で最も使用されているがん免疫療法薬ペムブロリズマブとの併用での薬効シグナルを評価する予定であり、これが得られた場合、CBA-1535は多くのがん患者さんに新たな治療法を提供できる可能性が広がります。
治験開始に先立ち5月16日キックオフミーティングが開催されましたので要旨を報告いたします。
キックオフミーティングには、実施医療機関の国立がん研究センター中央病院 先端医療科長 山本昇先生、静岡県立静岡がんセンター 消化器内科部長 山﨑健太郎先生、医学専門家の愛知県がんセンター 呼吸器内科部長 藤原豊先生、バイオマーカーアドバイザーの国立がん研究センター研究所 免疫創薬部門長 青木一教先生と、当社からは小林茂社長、田岡照世開発本部長、CBA-1535のプロジェクトチームメンバー、専門コンサルタントの総勢14名がオンラインで参加しました。

■キックオフミーティング要旨
①小林社長あいさつ
『がん治療の権威である先生方にご参加いただき、最高の布陣でCBA-1535の臨床試験を始められることを大変嬉しく思う。心より感謝申し上げる。先生方に加えて、研究から臨床に至る各段階において優秀な専門コンサルタントの支援と、社内の専門メンバーの配置により、小規模なベンチャー企業でありながら臨床試験推進に向けて最高のチームを組むことができた。Tribodyという新たな抗体フォーマットとして世界で初めての臨床試験であること、当社では未経験の T cell engager であることから、チャレンジングな開発だが、“アンメットメディカルニーズに創薬の光を” というビジョンを掲げる当社ならではの挑戦である。がん患者さんに新たな治療法を提供することを目標に一丸となって開発を進めたい。キックオフにあたって身が引き締まる思い。』
②試験の経緯およびプロトコル概要説明
『CBA-1535は2021年からPMDAへの事前相談を経て本年2月に治験計画届を提出され、実施医療機関での治験審査委員会(IRB)がまもなく開催予定(6月現在、各機関でのIRBは完了)。策定された治験計画に基づく予定症例数や評価項目、投与期間、サイクル、用量などの確認。第1相試験は、Part1およびPart2の2パートで構成され、Part1ではCBA-1535単剤での安全性と初期の薬効シグナルを、Part2ではCBA-1535とがん免疫療法薬ペムブロリズマブとの併用において安全性と薬効シグナルを、いずれも投与量を上げながら評価を行う。』
③非臨床試験結果報告
『非臨床で実施した薬理試験および毒性試験に関するデータの報告の実施。いずれの試験結果も問題点はなく、今後の第1相試験の実施の根拠となる。』
④先生方からの発言趣旨
『プロジェクトチームとの連絡を密に取り、施設間での情報連携を行いながら、十分に注意を払って実施していく。治験における懸念は十分に対応できる施設で細心の注意をもって実施されることから問題はないと考える。大変興味深い治療薬候補なので期待している。』
⑤田岡開発本部長あいさつ
『CBA-1535は諸先生方の強い関心と情熱に支えられて治験開始を迎えることができた。心より感謝申し上げる。CBA-1535は T cell engagerでTribodyという初めてのフォーマットであり、治験に参加してくださる患者さんに投与させていただいて、T細胞の動員があるのかをみていくことで、CBA-1535そのものだけでなくTribodyという新しいフォーマットとして当社の今後の研究開発につなげていく。臨床試験を進めていく上での重要な決定や報告は速やかにアドバイザリーボードを開催し先生方の助言を得ながら適切に対応していきたい。』