2023/06/30
カイオムニュースレター(Vol.9)
米国癌学会(AACR2023)における発表内容をレポートします。
~CBA-1205第1相臨床試験前半パート結果報告を含む4演題を発表しました~
2023年4月14日から19日に米国オーランドで開催されたAmerican Association for Cancer Research (AACR) Annual Meeting 2023において、当社のCBA-1205第1相臨床試験(ファースト・イン・ヒューマン試験 : jRCT2080225288)の前半パートの結果報告を含む4演題の発表を行いました。
今年のAACRは、世界中から現地参加あるいはオンライン参加で21,000人以上が参加されており、とても活気のある学会でした。

AACR Annual Meeting 2023
https://www.aacr.org/meeting/aacr-annual-meeting-2023/
CBA-1205第1相臨床試験前半パート結果報告
CBA-1205は、肝細胞がん、神経内分泌がん、一部の白血病などのがん細胞表面に発現している抗原(標的分子)「DLK-1(Delta-like 1 homolog)」に結合し、がんの増殖を抑制するヒト化モノクローナル抗体であり、当社が開発を進めるがん治療用抗体です。
DLK-1 は幹細胞や前駆細胞といった未熟な細胞の増殖、分化を制御する役割を担っていることが知られており、がん細胞の増殖に関与していることから、新しいがん治療の標的になりうる分子と考えられます。
現在実施している第1相臨床試験は、固形がんの患者さんを対象として主に安全性を確認する前半パートと、肝細胞がんの患者さんを対象に安全性と有効性を評価する後半パートに分かれており、今回のAACR2023では前半パートの結果を、治験実施施設の治験責任医師である国立がん研究センター東病院 肝胆膵内科長の池田公史先生が発表しました。
<試験結果の概要>
・実施した7コホート(投与量0.1~30mg/kgの7段階)において、22名の固形がんの患者さんにご参加いただいた。
・最高用量までDLT(用量制限毒性)やGrade3以上の重大な副作用は1例も認められず、高い安全性を確認。
・標準的治療法が無い、あるいは標準的治療法に不応又は不耐の固形がん患者さんを対象としており、8割以上が前治療として3次治療まで経験された患者さんが参加されているにも関わらず、22例中8例において腫瘍評価の最良総合効果でSD(安定)が認められた。
・特に、悪性黒色腫、胸腺腫、膵臓がんの患者さんでは長期間のSD継続が確認され、それぞれ80週(治験継続中)、39週、41週のPFS(無増悪生存期間)と、20.1%、24.0%、9.3%の腫瘍縮小が認められた。
・血清DLK-1濃度が検出限界以上で測定された患者さんは22例中6例だが、最良総合効果でSDであった患者さんではPD(進行)であった患者さんに比べて、血清DLK-1濃度の検出率や濃度が高い傾向があり、DLK-1がCBA-1205のバイオマーカーとなり得る可能性を示した。
これらの試験結果のとおり、固形がん患者さんを対象とした前半パートにおいて重大な毒性が認められず、高い安全性と忍容性が確認できたことから、現在は肝細胞がんの患者さんを対象とする後半パートに移行していることを発表しました。
<発表の様子>
AACRでは第1相臨床試験前半パート試験結果のほか、当社非臨床開発担当者より、動物モデル(HCC移植モデル)におけるCBA-1205とレンバチニブの併用による高い併用効果についても発表しました。
それぞれのポスターを見に来られた方々に、相互に関連する発表があることを伝え、CBA-1205の非臨床から臨床まで包括的に興味を持っていただきました。
臨床パートの報告では、新しいがん治療の標的になりうるDLK-1自体についての質問のほか、毒性所見が認められていないこと、バイオマーカーと有効性が相関する可能性について評価をいただきました。
<当社関係者コメント>
・治験責任医師 池田公史先生(発表者)
『発表時間は終始質問が途絶えることがなく、今回の発表への関心の高さを感じた。
特に、毒性の少なさからCBA-1205の高い安全性への驚きと関心がもたれた。』
・CBA-1205プロジェクトリーダー
『今回の発表ではFirst in classのターゲットDLK-1を標的としたCBA-1205への関心の高さを実感した。
引き続き、現在実施中の肝細胞がんの患者さんを対象とした後半パートでも、CBA-1205の治験の成功に向けて鋭意取り組んでまいりたい。』
<CBA-1205の現況と今後>
第1相臨床試験後半パートでは、AACRでの発表と同時期に、CBA-1205を投与された患者さん1例において、PR(部分奏功:30%以上の腫瘍縮小)が確認されました。(5/11決算発表において公表済み)
これからの開発に弾みがつく事象であり、当社は今後、2例目のPR症例の獲得を目指すとともに、患者さんの背景と抗腫瘍効果の関連性について解析を進めてまいります。
CBA-1535非臨床試験結果報告
今回のAACR2023では、当社の臨床開発二つ目のCBA-1535の非臨床試験結果についても発表しました。
CBA-1535は、当社が保有する多重特異性抗体作製技術Tribody™を用いて創製されたがん治療用抗体であり、非臨床試験(薬効薬理試験)において優れた抗がん剤としての特徴が示されています。
<データ発表の概要>
今回のAACR2023では、CBA-1535の構造的特徴を紹介するとともに、これまで得られているCBA-1535の有効性に関する研究データを紹介しました。
発表データの要旨は、以下の通りです。
・CBA-1535は、多くの固形がん細胞に発現する5T4および、がん細胞を攻撃するT細胞に発現するCD3の双方に高い結合力を持つが、5T4により強く結合する。
・CBA-1535は、5T4発現がん細胞存在下においては、低濃度からT細胞を活性化し、免疫反応の指標であるサイトカインを放出させるが、がん細胞が存在しないとその反応は引き起こされない。
・ヒトPBMC(T細胞などの免疫細胞群)と様々な種類のがん細胞の存在下にCBA-1535を添加すると強力ながん細胞傷害作用が認められた。中でも肺がんの細胞に対して強い活性が認められた。更に、免疫チェックポイント阻害薬として承認されているペムブロリズマブ(キイトルーダ®)とCBA-1535を同時に投与するとより強い作用が認められた。
・肺がんを移植したマウスモデルにおいて、溶媒投与群では腫瘍が増大したのに対し、CBA-1535を投与したマウス群では腫瘍の退縮効果がみられ、最高用量付近では完全な腫瘍増殖の抑制が認められた。一方で、体重や一般状態に対しての影響は認められなかった。 (下グラフ参照)
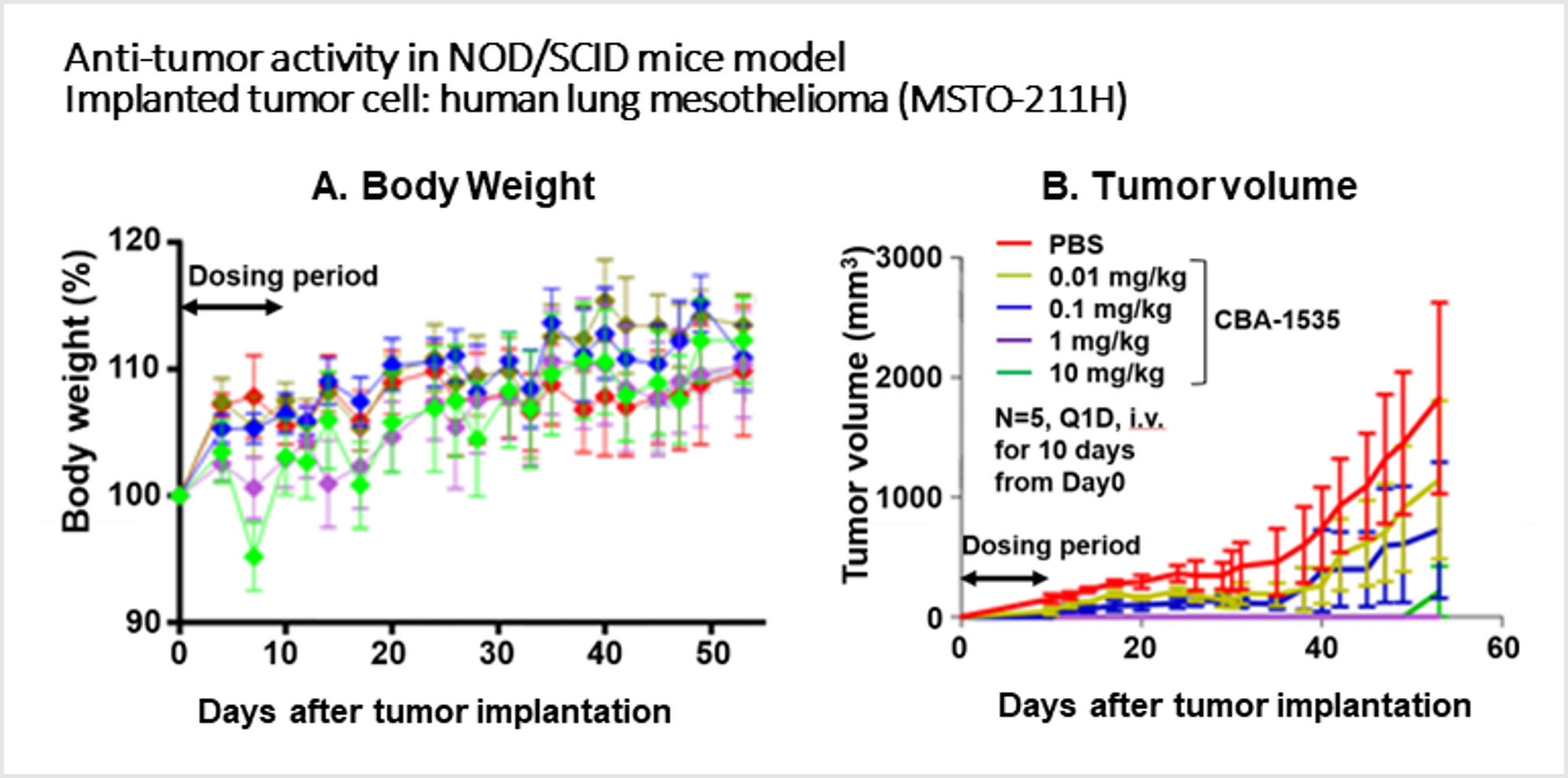
これらのデータから、CBA-1535はヒトにおける強力な抗腫瘍効果が期待できる新規薬剤であり、現在日本において第1相臨床試験(jRCT2031210708)を進行していることを説明しました。
<主な質疑内容>
Q: 2つの結合部位を5T4とした理由は?
A: 2つの結合部位を5T4とすることにより、より強力に標的であるがん細胞へ到達・結合することを意図した。
また、5T4は正常組織には発現していないことから、5T4結合による副作用のリスクは大きくないと考える。
Q: 5T4およびCD3への親和性は?
A: 親和性の指標であるKd値(値が低いほど強い結合)として5T4が4.6nM、CD3が25.5 nM。
がん細胞上の5T4への親和性を高くし、T細胞上にあるCD3への結合を弱くすることにより、全身性の免疫反応亢進のような副作用を低減することを期待している。
Q: 臨床試験の対象癌腫は?
A: 標的分子の5T4は多くの固形がんに高率で発現しているので、Ph1試験はすべての固形がん患者様を対象にしている。

<発表者コメント>
・CBA-1535非臨床試験担当者
『オーディエンスには大手製薬企業や投資会社、ベンチャーパートナーの方も目立ち、CBA-1535のビジネスとしての可能性を実感した。
Tribody™という新規のユニークな抗体フォーマットであることから、今後の臨床試験の結果に関心と期待を持つ方が多く、たくさんの励ましの言葉をいただいた。
当社が進める1535の臨床試験はTribody™フォーマットとして世界初であり、この取り組みに対して世界の科学者からの応援をいただけたことは、このプロジェクトにかかわるものとしてとても嬉しい。
現在カイオムではTribody™技術を活用して新たなパイプライン創出にも力を入れている。
ベンチャーならではの機動力でより優れたプロダクトを創出できるように邁進したい。 』



